四省药监局联合发文 新医械联盟来了
重磅进展,长三角医疗器械注册人制度一体化形成。
四省组成,新联盟形成
10月29日,据江苏省药品监督管理局消息,上海、江苏、浙江、安徽四地药监局联合发布《长江三角洲区域医疗器械注册人制度试点工作实施方案》。

据悉,这次的大举措是按照国家药品监督管理局《关于扩大医疗器械注册人试点工作的通知》的要求来进行,以长江三角洲区域医疗器械产业一体化。
由此可以看出,长三角医疗器械注册人制度一体化形成。“医疗器械注册人制度”这一医疗器械行业的创新性的改革,最早从上海试点,后扩大到天津、广东两地。
2019年8月,国家药监局相关通知又明确,北京、天津、河北、辽宁、黑龙江、上海、江苏、浙江、安徽、福建、山东、广东等21个省、自治区、直辖市参加医疗器械注册人制度试点。
怎么联合?有什么影响?
什么是医疗注册人制度,经历了怎样的变革?
此前,在2014年10月起实施的《医疗器械生产监督管理办法》中明确规定,拿到医疗器械注册证才能申请第二类、第三类医疗器械的生产许可证,而取得生产许可才能生产、受托生产相应医疗器械。也即把注册与生产许可捆绑在一起,必须由一个主体来完成。
现在,医疗器械注册人制度发生改革,允许企业、机构和人员单独申请医疗器械注册证,再以注册人的身份委托其他企业生产相应的医疗器械。即注册和生产许可可以不由一个主体来完成。
模式变化:
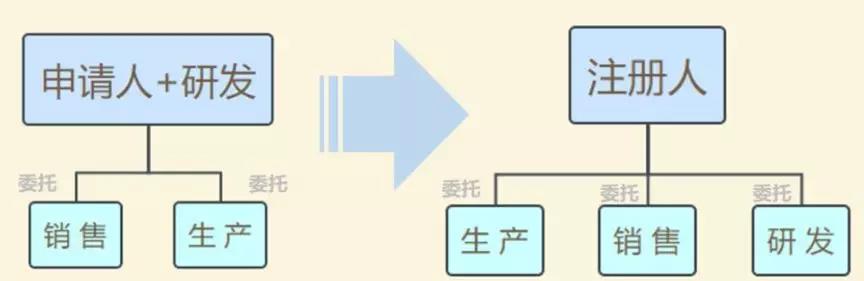
(图片来源:CFDA法规在线)
“注册人制度实现了产品注册和生产许可的解绑,更利于鼓励创新、整合社会资源、加快医疗器械产品上市”,上海市药监局医疗器械监管处处长林森勇认为。
多家企业初尝甜头
在具体落实上,经国务院批准,行业变局由上海开启。
2018年2月8日,上海远心医疗科技有限公司的单道心电记录仪获得由上海市药监部门颁发的第二类医疗器械产品注册证,成为国内首个享受到医疗器械注册人制度新政的产品。
持有注册证的远心医疗和受托生产的微创电生理都隶属于上海微创,其由此成为我国医疗器械注册人制度试点的首个赢家。
上海微创医疗器械有限公司副总裁李勇说,从我们企业试点实践来看,新政大大节约了研发成本投入。以我们首个获得试点注册证的产品为例,节约了1000多万元研发投入。
尝到甜头的上海微创,尝试力度越来越大。截至目前,该企业已经有7家公司12个产品申请注册人,其中有2个产品已获得注册证。
据悉,除上海微创的2个产品外,上海还有4家企业6个产品在试点过程中获批。试点形式还出现了扩大生产场地、多点委托,注册人为科研型企业、医工互动,非关联主体跨区域委托、进口产品转国产化等。
美敦力、迈瑞接连响应
医疗器械注册人制度可以缩短产品上市周期、提高效率的优势已经显现,而且从上海的实践也能印证,制度改革已经为行业带来改变,国内医械龙头企业也接连“启航”。
就美敦力来说,与上海微创不同的是,美敦力的委托生产方为捷普科技(上海)有限公司,这是一家专业的第三方代工企业。以其获批的手术动力系统为例,委托后,该产品获批上市仅用了45天的时间。
上海市药监局医疗器械注册处处长林峰就此表示,该产品原应作为进口产品注册,但在试点过程中是本地注册、本地制造,使得本地化转移成为可能。该产品上市也意味着将来我国会有更多先进医疗器械不再通过进口,而是通过本地注册、生产,实现快速上市。
多方期待试点范围扩大
从目前各地实施的结果来看,注册人制度试点工作取得一定成效,但还存在一定问题。
比如一些企业将注册人制度简单理解为委托生产,没有意识到注册人要对医疗器械全生命周期的质量管理承担主体责任;有些企业为享受试点期间的鼓励政策(如优先审评等),刻意拆分出持证人或受托人;部分持有人和委托人之间产生知识产权纠纷等。
需要看到的是,由于目前试点范围的局限性,医疗器械注册人制度虽然不断释放红利,但是速率方面还需加强。
浙江省药监局有关负责人坦言,资本的逐利性决定其会选择环境好、成本低的地区进行生产。上海的生产成本相对较高,注册人完全可到周边省份去寻找合作伙伴。尤其是在“将长三角区域一体化发展上升为国家战略”背景下,注册人试点应拓展到上海周边省份。
业内人士就此问题谈到,在试点过程中,医疗器械注册人应当具备哪些能力或者条件,应当承担哪些义务;医疗器械注册人制度实施会给监管带来哪些挑战,这些挑战如何破解等问题,还需进一步讨论与研究,需要在实践中不断探索。
来源:赛柏蓝器械



